
Entwicklung besonders stabiler Eiweiße gelungen
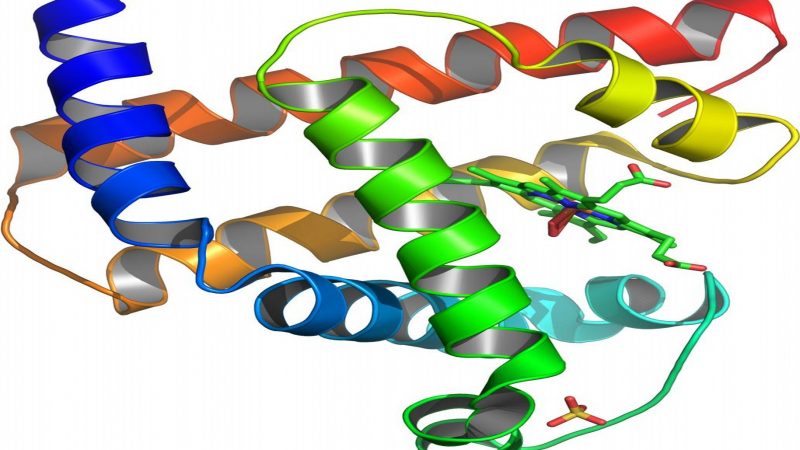
Wenn Proteine erhitzt werden, falten sich ihre langkettigen Moleküle auseinander, was es ihnen unmöglich macht, Funktionen zur Aufrechterhaltung des Lebens – wie die Umwandlung von Nahrung in Energie oder das Übertragen von Sauerstoff ins Blut – zu erfüllen. Bis jetzt nahm man an, Wasser sei für die Funktion von Eiweißmolekülen und die Auflösung der Gerinnung während des Abkühlens essentiell.
Neue Forschungen der englischen Universität Bristol zeigten, dass ein bestimmtes Eiweiß – Myoglobin, das in roten Blutzellen gefunden wurde – sich auch ohne Wasser wieder lösen kann.
„Unsere Ergebnisse stellen das Paradigma über die Rolle von Wasser bei der Lösung und Funktion von Eiweißen infrage“, erklärte Dr. Adam Perriman von der School of Chemistry in Bristol der Epoch Times in einer E-Mail. „Das ist ein extrem komplexes Thema und betrifft praktisch alle Arten chemischer Verbindungen, die unter dem Einfluss von Wasser stehen.“
Das Gerinnen von Proteinen wird Denaturierung genannt und vollzieht sich beim Erhitzen. Ein klassisches Beispiel ist das Kochen eines Eis, wobei sich die Proteine im Ei entfalten und verkleben und das Ei dadurch fest wird. Dieser Prozess kann in Eiern nicht umgekehrt werden. Aber es gibt einige Proteine, die bei der Abkühlung wieder ihre frühere Struktur annehmen.
In den Neunzigerjahren waren überall in den Medien die sogenannten Buckyballs zu sehen (Kohlenstoff in der Kristallstruktur eines Fußballs, der fest bzw. gasförmig, aber nicht flüssig vorkommt). Wenn ein festes Stück dieses Stoffes erhitzt wird, bildet es sofort Gas. Wird das Gas andererseits abgekühlt, bildet sich wieder eine feste Substanz“, präzisierte Perriman. „Dieses Phänomen ist beispiellos und durch die Winzigkeit der Struktur des Buckyballs begründet. Die Proteine sind Objekte im Nanometerbereich und nehmen deshalb keinen flüssigen Zustand an.“
Perriman und seine Teamkollegen veränderten die Oberfläche des sauerstofftragenden Moleküls Myoglobin unter Nutzung von oberflächenaktiven Polymeren, sodass das Protein die Fähigkeit erlangte, zu „schmelzen“ und beseitigten alle Spuren von Wassermolekülen in dessen Umgebung.
„Als ich bemerkte, dass die Proteinstruktur trotz Abwesenheit von Wasser (oder eines anderen Lösungsmittels) noch intakt war, beschloss ich auszuprobieren, ob das Protein durch Erhitzung gerinnt und sich erneut löst, wenn es sich abkühlt“, sagte Perriman. „Und das hat sich bestätigt.“
Die Forscher nutzen eine Technik, die Zirkulardichroismus genannt wird. Diese ermöglicht es, optisch aktive Moleküle mit zirkular polarisiertem Licht zu untersuchen. An der Diamond Light Source synchrotron science facility in Oxfordshire konnte damit beobachtet werden, wie sich die Struktur des Myoglobins bei der Erhitzung verhielt. Es ergab sich, dass das Protein auch bei ungewöhnlich hohen Temperaturen stabil blieb.
„In Wasser gerinnen (denaturieren) die meisten Proteine bei 70 bis 80 Grad Celsius. Wir jedoch beobachteten die Gerinnung in einem lösungsfreien System erst bei 155 Grad Celsius“, berichtete Perriman.
Diese Entdeckungen könnten nützlich sein bei der Entwicklung von industriellen Enzymen mit einer hohen Hitzebeständigkeit, also in Umgebungen mit extremen Bedingungen“, betonte Perriman. „Eines unserer Schlüsselresultate war der sehr große Anstieg der Eiweißstabilität. Darüber hinaus haben unsere flüssigen Eiweiße eine sehr hohe Eiweißkonzentration, was ebenfalls von Vorteil sein könnte.“
„Andere Anwendungsmöglichkeiten könnten intelligente Wundauflagen sein, die als Aerosol mit einer Sprühdose aufgetragen werden“, ergänzte Perriman. „Zurzeit befindet sich die Arbeit allerdings noch in einem sehr frühen Stadium, aber wir haben bereits einige neue Systeme im Blick, bei denen industriell relevantere Enzyme eine Rolle spielen.“
Die Ergebnisse wurden online im Journal Chemical Science veröffentlicht.

























vielen Dank, dass Sie unseren Kommentar-Bereich nutzen.
Bitte verzichten Sie auf Unterstellungen, Schimpfworte, aggressive Formulierungen und Werbe-Links. Solche Kommentare werden wir nicht veröffentlichen. Dies umfasst ebenso abschweifende Kommentare, die keinen konkreten Bezug zum jeweiligen Artikel haben. Viele Kommentare waren bisher schon anregend und auf die Themen bezogen. Wir bitten Sie um eine Qualität, die den Artikeln entspricht, so haben wir alle etwas davon.
Da wir die Verantwortung für jeden veröffentlichten Kommentar tragen, geben wir Kommentare erst nach einer Prüfung frei. Je nach Aufkommen kann es deswegen zu zeitlichen Verzögerungen kommen.
Ihre Epoch Times - Redaktion