
RKI-Protokolle: AstraZeneca Impfstoff „weniger perfekt“ und doch mit „gutem Sicherheitsprofil“?
Aus den jetzt weitestgehend ungeschwärzten RKI-Protokolle des COVID-19-Krisenstabs für den Zeitraum Januar 2020 bis April 2021 geht hervor, dass die Bereitschaft in der Bevölkerung, sich mit den im „Schnelldurchgang“ entwickelten COVID-Impfstoffen impfen zu lassen, nur zögerlich wuchs.
Anfangs gab es insbesondere beim medizinischen Personal Bedenken. So heißt es in einem Eintrag der RKI-Protokolle vom 30. Oktober 2020, dass sich nur 53 Prozent der Bevölkerung impfen lassen würde und die niedrigste Akzeptanz beim medizinischen Personal existiere.
Hinter dieser Haltung steckten oftmals Sicherheitsbedenken, wie eine RKI-Studie, veröffentlicht am 4. Oktober 2021, zeigte.
Eine Befragung von Krankenhauspersonals zwischen dem 28. Juni und dem 26. Juli 2021 ergab, dass Angst vor bleibenden Schäden, die Befürchtung, dass die neuen Impftechnologien nicht sicher seien und der Wunsch abzuwarten, die Hauptgründe dafür waren, dass sich Teile des medizinischen Personals gegen eine COVID-19-Impfung entschieden.
Die Bedenken zur COVID-Impfung waren nicht unbegründet, wie ein Protokolleintrag vom 8. Januar 2021 zeigt. Während der BioNTech-Impfstoff bereits zugelassen war und ab dem 27. Dezember 2020 verimpft wurde, zeigten sich Schwierigkeiten bei der Zulassung des Vektor-Impfstoffs von AstraZeneca.
„Kein Selbstläufer wie die anderen, da Impfstoff weniger perfekt ist“, heißt es. Der Einsatz müsse diskutiert werden. Dabei ging es offenbar zunächst um die geringe Wirksamkeit, gerade bei den über 65-Jährigen.

Ausschnitt aus den weitestgehend entschwärzten COVID-19-Krisenstabsprotokollen des Robert Koch-Instituts. Foto: Bildschirmfoto/RKI-Protokolle
EMA und PEI geben AstraZeneca-Impfstoff frei
Am 29. Januar 2020 erteilte die EU-Kommission nach Empfehlung der Europäischen Arzneimittel-Agentur (EMA) für die EU und den Europäischen Wirtschaftsraum die bedingte Zulassung für den AstraZeneca-Impfstoff. In Deutschland ist vor dem Einsatz eines Vakzins zusätzlich die staatliche Chargenfreigabe durch das Paul-Ehrlich-Institut (PEI) erforderlich, die ebenfalls erfolgte.
In der damaligen Mitteilung des PEI heißt es: „Die bislang ermittelte Wirksamkeit des Impfstoffprodukts nach zweimaliger Impfung im Abstand von vier bis 12 Wochen ist mit 60 Prozent geeignet, einen wichtigen Beitrag zur Pandemiebekämpfung zu leisten. Dafür spricht ebenso das gute Sicherheitsprofil des COVID-19-Impfstoffs von AstraZeneca.“
Doch wie verkauft man einen Impfstoff mit niedriger Wirksamkeit?
„Begleitkommunikation wird vorbereitet, Wirksamkeit mit 70 Prozent signifikant niedriger, mit Impfstoff wird v.a. Gesundheits- und Pflegepersonal geimpft“, steht im RKI-Protokoll vom 29. Januar 2021. Dabei ist auffallend, dass der RKI-Krisenstab eine zehn-prozentig höhere Wirksamkeit angibt als das PEI.
Weiter heißt es: „Viele zusätzliche Fragen: Erst AstraZeneca Impfstoff und später RNA-Impfstoff wenn der für alle verfügbar ist? […] Problematik der Deutung als 2-Klassen-Impfstoff, Vergleiche zu anderen Impfstoffen schwierig, besser Argumentation: jetzt Schutz mit 70 Prozent vs. potenzielle Exposition und danach Impfstoff mit höherer Wirksamkeit.“
Im RKI-Protokoll vom 19. Februar 2021 zeigt sich dann jedoch: „Medien berichten vermehrt Nebenwirkungen (NW), dies ist nicht ganz überraschend, NW-Profil ist bekannt.“
Dies wird im Anschluss damit erklärt, dass mehr jüngere Erwachsene mit dem Vakzin des britisch-schwedischen Herstellers geimpft würden und diese sind häufiger „reaktogener“ wären, also leichter zu Reaktionen neigen würden als ältere Menschen. „Wird außerdem medial aufgebauscht, da das Vertrauen in diesen Impfstoff niedriger ist“, heißt es dann weiter.

Ausschnitt aus den weitestgehend entschwärzten COVID-19-Krisenstabsprotokollen des Robert Koch-Instituts. Foto: Bildschirmfoto/RKI-Protokolle
Vorübergehende Aussetzung der AstraZeneca-Impfungen
Es deuteten sich weitere Probleme mit dem AstraZeneca-Impfstoff an. „Viel Aufregung generell […] Jetzt 12 Fälle mit Sinusvenenthrombose: alle 12 Frauen nach Impfung mit AstraZeneca, alle <55 Jahre, auffälliges Cluster“, heißt es in einem Eintrag vom 19. März 2021.
Zuvor, am 4. März 2021, gab das RKI bekannt, trotz der Meldungen von Nebenwirkungen die Impfkampagne zunächst weiterlaufen zu lassen. Die beim RKI angegliederte Ständige Impfkommission (STIKO) habe eine intensive Analyse und Bewertung von neuen Studiendaten durchgeführt, die erst innerhalb der vergangenen Tage verfügbar wurden.
Die Daten, aus England und Schottland, würden erstmals „robuste Ergebnisse zur guten Wirksamkeit“ des Impfstoffs in höheren Altersgruppen bereits nach einer Impfstoffdosis liefern. „Die Wirksamkeit wurde in Bezug auf die Verhinderung von COVID-19-Erkrankungen und insbesondere auch in Bezug auf die Verhinderung schwerer Krankheitsverläufe eindrücklich belegt.“
Am 15. März 2021 teilte das PEI mit, das für die Impfstoffüberwachung in Deutschland zuständig ist, dass gegenüber dem Stand vom 11. März 2021 inzwischen weitere Fälle in Deutschland von Sinusvenenthrombosen im Gehirn gemeldet wurden.
Die PEI-Experten hätten den neuen Datenstand analysiert und dabei eine auffällige Häufung einer speziellen Form von sehr seltenen Hirnvenenthrombosen in Verbindung mit einem Mangel an Blutplättchen (Thrombozytopenie) und Blutungen in zeitlicher Nähe zu Impfungen mit dem AstraZeneca-Impfstoff festgestellt.
„Bis zum Abschluss der Bewertung durch die EMA werden die Impfungen mit dem COVID-19-Impfstoff von AstraZeneca in Deutschland ausgesetzt. Die heutige Entscheidung betrifft sowohl Erst- als auch Folgeimpfungen“, heißt es.
EMA hielt AstraZeneca-Impfstoff für sicher
Die EMA sah nach einer wiederholten Prüfung offenbar kein Problem.
„EMA hat entschieden der Impfstoff ist sicher“, so das RKI-Protokoll vom 19. März 2021. „Aufträge von EMA und STIKO [sind] verschieden.“
„STIKO entscheidet über beste Einsetzung von Impfstoffen und überlegt, ob bei diesem [Risiko-]Signal gewisse Personengruppen lieber mRNA Impfstoff geimpft werden sollten, dies ist jedoch kommunikativ und bzgl. Akzeptanz schwierig, dennoch intern intensive Diskussion.“

Ausschnitt aus den weitestgehend entschwärzten COVID-19-Krisenstabsprotokollen des Robert Koch-Instituts. Foto: Bildschirmfoto/RKI-Protokolle
Gleichzeitig war dem RKI bekannt, dass andere Länder den AstraZeneca-Impfstoff bereits aus ihrem Impfprogramm herausgenommen hatten: „Einige Länder in Europa haben anders entschieden, z.B. setzt Norwegen Impfprogramm mit AstraZeneca bis auf weiteres aus, auch abhängig von Fallzahlen.“
Dänemark hat als erstes EU-Land die Impfung mit AstraZeneca im März 2021 komplett eingestellt. Norwegen hat das Vakzin erst vorläufig und dann im Mai endgültig aus seinem Impfprogramm herausgenommen. Die STIKO entschied aber anders.
„Heute erfolgt Veröffentlichung der STIKO-Empfehlung/ Stellungnahme, AstraZeneca weiter wie bisher anzuwenden jedoch unter genauer Beobachtung“, heißt es im RKI-Protokoll vom 19. März 2021 weiter.

Ausschnitt aus den weitestgehend entschwärzten COVID-19-Krisenstabsprotokollen des Robert Koch-Instituts. Foto: Bildschirmfoto/RKI-Protokolle
Auf der RKI-Website war als Begründung zu lesen:
Der Nutzen der Impfung überwiegt die gegenwärtig bekannten Risiken.“
Die STIKO stellte auch fest, dass die Thrombosenfälle ein Sicherheitssignal darstellen, „allerdings ist die insgesamt vorliegende Evidenz derzeit begrenzt.“ Die Kommission werde alle Daten genau überwachen und bewerten.
Vermehrtes Auftreten von Thrombosen
Im RKI-Protokoll vom 9. April 2021 zeigt sich dann ein eindeutiges Bild: „Sinusthrombosen als Nebenwirkung des AstraZeneca Impfstoffs: in D und Skandinavien sind die Fallzahlen 10 Mal so hoch wie in England. Inzwischen sind auch vermehrt Männer davon betroffen (aktuell 7 Fälle bei Männern in Deutschland) und damit gibt es auch bei Männern eine zwanzigfach erhöhte Inzidenz im Vergleich zur Hintergrundinzidenz.“
Die STIKO änderte dann zum 1. April ihre Empfehlung für AstraZeneca geändert und empfahl den Impfstoff nur noch für über 60-Jährige.
Dies erklärte die Kommission damit, dass neue Erkenntnisse zur Sicherheit des Impfstoffes gewonnen wurden, „die vorher nicht vorlagen, da die Anzahl geimpfter Personen in den Zulassungsstudien nicht ausreichte, um diese zu erkennen“.
Diese neu verfügbaren Daten zum Auftreten „seltener, aber sehr schwerer thromboembolischer Nebenwirkungen“ zeigten, dass diese besonders bei Personen jünger als 60 Jahre vorkamen.
Laut dem Paul-Ehrlich-Institut wurde der Impfstoff bereits seit dem 1. Dezember 2021 in Deutschland nicht mehr eingesetzt.
Hersteller räumt „seltene schwere Nebenwirkungen“ ein
Im April 2024 räumte der britisch-schwedische Hersteller erstmals ein, dass sein COVID-19-Impfstoff seltene schwere Nebenwirkungen wie Blutgerinnsel und niedrige Thrombozytenzahlen verursachen kann.
In einer im Vereinigten Königreich eingereichten Sammelklage wird behauptet, das Vakzin habe zu Todesfällen und schweren Verletzungen geführt, und es wird Schadenersatz in Höhe von bis zu 100 Millionen Pfund für etwa 50 Opfer gefordert.
Seit dem 7. Mai 2024 ist der AstraZeneca-Impfstoff in der EU nicht mehr zugelassen. Der Hersteller begründete seinen Rückzieher bei der Zulassung mit einer geringen Nachfrage und kommerziellen Gründen.
Laut RKI-Protokoll vom 22. Januar 2020 hatte Deutschland 50 Millionen AstraZeneca-Impfdosen vorbestellt. In einem Eintrag vom 17. August 2020 heißt es, dass die EU einen Vertrag über 400 Millionen AstraZeneca-Impfdosen abgeschlossen hatte.
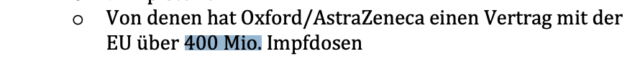
Ausschnitt aus den weitestgehend entschwärzten COVID-19-Krisenstabsprotokollen des Robert Koch-Instituts. Foto: Bildschirmfoto/RKI-Protokolle
In Deutschland wurden laut dem RKI-Impfquotenmonitoring (Stand 28. Mai 2024) rund 13 Millionen AstraZeneca-Impfdosen seit Anfang Februar 2021 verimpft.
EU-weit wurden rund 68,8 Millionen Impfdosen des schwedisch-britischen Herstellers, an über 18-Jährige verabreicht. Und weltweit sollen laut AstraZeneca über drei Milliarden Dosen an über 180 Länder ausgeliefert worden sein.
































vielen Dank, dass Sie unseren Kommentar-Bereich nutzen.
Bitte verzichten Sie auf Unterstellungen, Schimpfworte, aggressive Formulierungen und Werbe-Links. Solche Kommentare werden wir nicht veröffentlichen. Dies umfasst ebenso abschweifende Kommentare, die keinen konkreten Bezug zum jeweiligen Artikel haben. Viele Kommentare waren bisher schon anregend und auf die Themen bezogen. Wir bitten Sie um eine Qualität, die den Artikeln entspricht, so haben wir alle etwas davon.
Da wir die Verantwortung für jeden veröffentlichten Kommentar tragen, geben wir Kommentare erst nach einer Prüfung frei. Je nach Aufkommen kann es deswegen zu zeitlichen Verzögerungen kommen.
Ihre Epoch Times - Redaktion